ПРИРОДНЫЕ ИСТОЧНИКИ АЛКАНОВ
Основными природными источниками алканов являются нефть и природный газ.
Состав природного газа зависит от месторождения: обычно в нем содержится от 75% до 95% метана, а этана и пропана значительно меньше. Нефть содержит алканы от С5Н12 до С30Н62 нормального и разветвленного строения. Кроме того, иногда рядом с угольными пластами встречаются и отдельные залежи твердых высших алканов в виде озокерита, или горного воска.
ПРОМЫШЛЕННЫЕ СПОСОБЫ
Основной промышленный способ получения алканов – переработка нефти. Альтернативой может служить прямой синтез из угля и водорода:
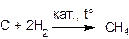
ЛАБОРАТОРНЫЕ СПОСОБЫ
Гидролиз карбида алюминияпозволяет получить метан:

Другие алканы этим способом получить нельзя.
Сплавление натриевых солей карбоновых кислот со щелочами. Эта реакция протекает при нагревании смеси порошков соли карбоновой кислоты и гидроксида натрия и сопровождается декарбоксилированием, то есть отщеплением группы
-СООNa от молекулы соли. В молекуле образующегося алкана остается на один атом углерода меньше, чем в молекуле исходной соли, например:
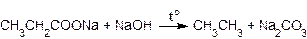
Электролиз водных растворов натриевых или калиевых солей карбоновых кислот (синтез Кольбе)также сопровождается декарбоксилированием. Продуктами реакции являются симметричные углеводороды, например:
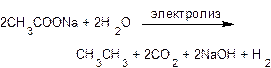
В ходе электролиза на аноде анионы СН3СОО- окисляются до радикалов СН3СОО∙, которые распадаются с образованием радикалов СН3∙ и углекислого газа СО2. Радикалы СН3∙ соединяются попарно, и образуется молекула этана.
Реакция галогеналканов с натрием (реакция Вюрца)позволяет получать углеводороды с удвоенным числом атомов углерода по сравнению с исходным соединением, например:
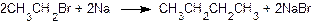
Если в реакцию ввести смесь двух галогеналканов, то образуются одновременно три продукта, например:
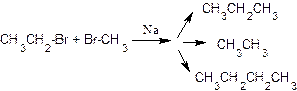
ДОПОЛНЕНИЯ К ЛЕКЦИИ «АЛКАНЫ»
Приложение 1. Первичные, вторичные, третичные и четвертичные атомы углерода. Нормальная и разветвленная углеродная цепь.
В молекулах гомологов метана принято различать первичные, вторичные, третичные и четвертичные атомы углерода в зависимости от числа связей, направленных данным атомом на связь с другими атомами углерода. Первичным называется атом углерода, связанный непосредственно с одним атомом углерода (три оставшиеся валентности направлены на связь с атомами водорода); вторичным – с двумя атомами углерода. Третичный атом углерода связан непосредственно с тремя, а четвертичный – с четырьмя атомами углерода (рис. 1).
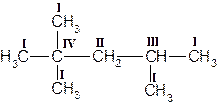
Рисунок 1. Структурная формула молекулы 2,2,4-триметилпентана. Первичные, вторичные, третичные и четвертичные атомы углерода обозначены соответственно цифрами I, II, III, IV.
Углеродную цепь относят к нормальной (неразветвленной), если она содержит только первичные и вторичные атомы углерода, например:
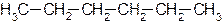
Соответствующий углеводород называют алканом нормального строения или просто нормальным алканом.
Если же в углеродной цепи содержатся третичные или четвертичные атомы углерода, то ее называют разветвленной. Алкан с такой цепью называют разветвленным, например:
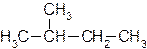
или
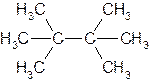
.
Приложение 2. Механизм реакции радикального хлорирования метана.
1. Под действием света или нагревания в молекуле хлора разрывается ковалентная связь с образованием двух свободных радикалов:
Cl2 → 2Cl·
Свободные радикалы ‑ это частицы, содержащие неспаренный электрон. Они очень химически активны и быстро вступают в следующие стадии реакции.
2. Столкновение радикала Cl· с молекулой метана приводит к образованию молекулы HCl и радикала СН3∙, который, взаимодействуя со следующей молекулой хлора, дает хлорметан CH3Cl и радикал Cl·:
Cl· +CH4 → HCl + CH3·
CH3· + Cl2 → CH3Cl + Cl·
Эти процессы могут повторяться многократно, приводя к продолжению реакции (развитию цепи).
3. Возможны и «нежелательные» столкновения, приводящие к гибели свободных радикалов:
Cl· + Cl· → Cl2
CH3· + Cl· → CH3Cl
CH3· + CH3·→ СН3СН3
В результате последней реакции соединяются два радикала CH3·, поэтому в продуктах реакции хлорирования метана можно обнаружить некоторое количество этана.

